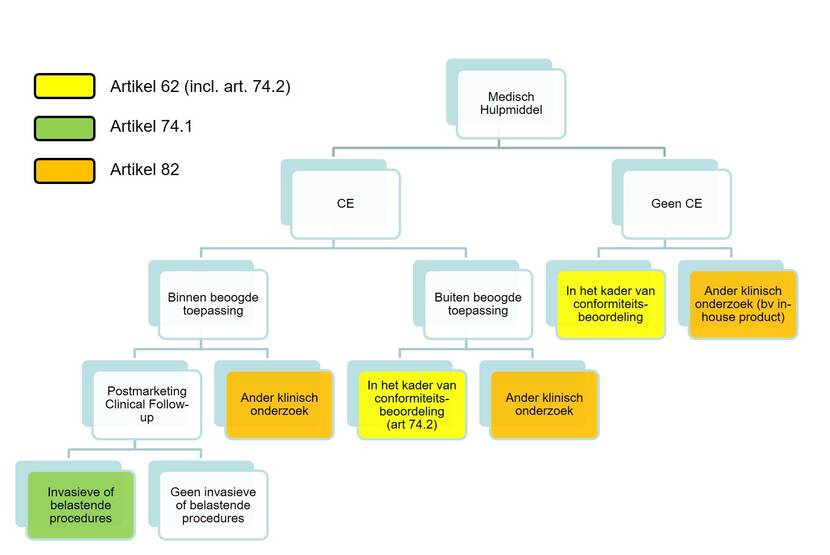
In de MDR worden verschillende kaders voor klinisch onderzoek benoemd. Welk kader van toepassing is hangt af van het doel van de studie. Onderstaand schema kan helpen bij het bepalen welk kader van toepassing is. Onder conformiteitsbeoordeling wordt verstaan de productontwikkeling en het verkrijgen/uitbreiden van een CE-markering.
©CCMO
Kort samengevat gelden onder de MDR vanaf 26 mei 2021 de volgende wettelijke kaders en bijbehorende procedures voor de verschillende doelen van een studie:
- Artikel 62: Klinisch onderzoek dat wordt uitgevoerd in het kader van een conformiteitsbeoordeling (d.w.z. in het kader van productontwikkeling en het verkrijgen van een CE-markering).
- De indiening vindt centraal plaats via ToetsingOnline.
- Het Landelijk Bureau van de CCMO valideert.
- De toetsing vindt plaats conform de bepalingen in de MDR.
- Artikel 74.2: Klinisch onderzoek met een CE-gemarkeerd medisch hulpmiddel dat wordt uitgevoerd in het kader van een conformiteitsbeoordeling voor een andere toepassing.
- De indiening vindt centraal plaats bij de CCMO.
- Het Landelijk Bureau van de CCMO valideert.
- De toetsing vindt plaats conform de bepalingen in de MDR.
- Artikel 74.1: Klinisch onderzoek met een CE-gemarkeerd medisch hulpmiddel als onderdeel van de postmarketing clinical follow-up (PMCF) waarbij proefpersonen extra invasieve of belastende procedures ondergaan.
- De indiening vindt plaats volgens de huidige procedure.
- De toetsing vindt plaats conform de bepalingen in de MDR waarbij minder bepalingen gelden dan voor klinisch onderzoek dat valt onder artikel 62 of 74.2.
- Artikel 82: Klinisch onderzoek met een medisch hulpmiddel dat niet valt onder artikel 62 of artikel 74. Hieronder valt bijvoorbeeld klinisch onderzoek naar in-house of naar maat gemaakte medische hulpmiddelen of klinisch onderzoek waarbij twee medische hulpmiddelen (CE-gemarkeerd en toegepast conform de CE-markering) met elkaar worden vergeleken.
- De indiening vindt plaats volgende de huidige procedure.
- De toetsing vindt plaats conform de bepalingen in de MDR waarbij minder bepalingen gelden dan voor klinisch onderzoek dat valt onder artikel 62 of 74.2 aangevuld met bepalingen uit de reeds gewijzigde Wet medische hulpmiddelen.
De reikwijdte van klinisch onderzoek dat onder artikel 62 en artikel 82 valt wordt nog bediscussieerd binnen de Europese Unie.



